ALCOHOLES Y FENOLES
Introducción
Este blog pretende orientar el uso de las diferentes metodologías de aprendizaje en el área química, teniendo en cuenta un tema en específico como los alcoholes y fenoles.
Por medio de éste, tendremos en cuenta lo que son los alcoholes y los fenoles.
Objetivos:
- Tener clara la teoría acerca los alcoholes y los fenoles, sus características.
- Realizar un repaso por medio de ejercicios virtuales.
- Poner en práctica lo aprendido en clase de química orgánica.
Alcoholes
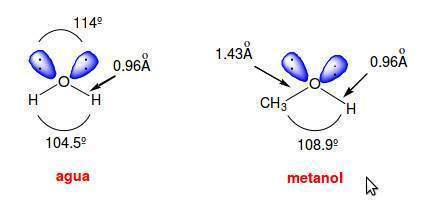
La estructura de un alcohol se asemeja a la del agua puesto que un alcohol procede de la sustitución formal de uno de los hidrógenos del agua por un grupo alquilo.
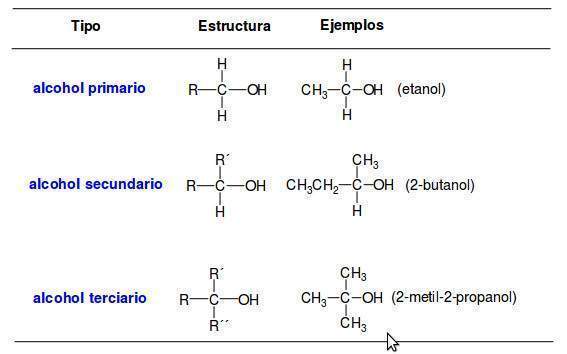
Una manera de organizar la familia de los alcoholes es clasificar a los alcoholes en primarios, secundarios o terciarios de acuerdo con el tipo de átomos de carbono enlazados al grupo OH. En la siguiente tabla se indican las estructuras de los alcoholes según su grado de sustitución:
En la nomenclatura de alcoholes se suelen emplear nombres vulgares para los términos más sencillos ( C1 - C4 ). Estos nombres se forman con la palabra alcohol.
El sistema IUPAC nombra a los alcoholes de acuerdo a las siguientes reglas:
- Se busca la cadena más larga que incluya el Grupo Hidroxilo. La terminación o del hidrocarburo se cambia por -ol.
- La cadena se numera de forma que al grupo funcional le corresponda el menor número posible. Si hay mas de un grupo hidroxilo en la cadena, se emplean los prefijos di, tri, etc.
- Cuando el alcohol no es el grupo funcional principal se nombra como hidroxi, precedido de su número localizador.
En cuanto a sus propiedades, los alcoholes de baja masa molecular, están a temperatura ambiente en estado líquido y son incoloros, además de solubles en agua en mayor o menor medida.
A medida que aumenta el tamaño de la molécula también aumenta su punto de fusión y baja su solubilidad en el agua, llegando a poder estar en algunos casos en estado solido a temperatura ambiente. Aunque la mayoría de alcoholes tienen una densidad menor que la del agua, algunos, especialmente los que cuentan con anillos aromáticos, poseen una densidad mayor. La polaridad de los grupos -OH permite a estas moléculas establecer enlaces puente de hidrógeno con moléculas compañeras, o con aniones.
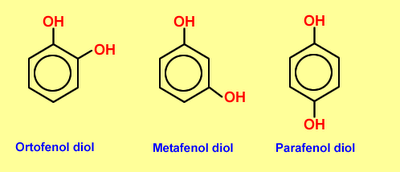
Fenoles
El fenol es una sustancia blanca, cristalina a temperatura ambiente, de color blanco-incoloro con un olor distintivo, acre y aromático.
Su Fórmula química es C6H5OH, y tiene un Punto de fusión de 43 °C y un Punto de ebullición de 182 °C. El fenol no es un alcohol, debido a que el grupo funcional de los alcoholes es R-OH,y en el caso del fenol es Ph-OH. El fenol es conocido también como ácido fénico o ácido carbólico, cuya Ka es de 1,3 • 10-10. Se puede detectar el sabor y el olor del fenol a niveles más bajos que los asociados con efectos nocivos. El fenol se evapora más lentamente que el agua y una pequeña cantidad puede formar una solución con agua. El fenol se inflama fácilmente, es corrosivo y sus gases son explosivos en contacto con la llama. El producto comercial es un líquido. Tiene un olor repugnantemente dulce y alquitranado
El fenol se presenta en la Naturaleza en la madera y en las agujas de pino, en la orina de los herbívoros (fenolsulfato) y en el alquitrán de hulla. Puede sintetizarse mediante la Oxidación parcial del Benceno. El fenol se obtiene a partir de la destilación del alquitrán de hulla. Según RÖMPP 1983, con 1 tonelada de hulla se obtiene aproximadamente 0,25 kg de fenol Actualmente, predomina la producción sintética por disociación del Hidroperóxido de cumeno, obteniéndose acetona como producto secundario
Usos y reacciones principales:
- Los halógenos, forman principalmente, dihalofenoles y trihalofenoles; los derivados del cloro, son los principales, puesto que el cloro con el fenol, forma dos derivados principales, que se usan como herbicidas y preservadores de madera, como son el diclorofenol y el pentaclorofenol:
C6H5 = CH + 2Cl2 C6H3 ( C12) - OH + 2HC1 C6H5 = OH + 5Cl2 C6(C15) - OH + 5HC1 Estas reacciones se llevan a cabo en presencia de los llamados Ácidos Lewis, por ejemplo: Cloruro de aluminio, Fluoruro de boro, etc.
- La reacción del fenol con el Ácido sulfúrico, es para la obtención del Ácido hidroxibencensulfónico:
C6H5 - OH + H2SO4 C6H4 (SO3H) - OH + H2O.
- La nitración del fenol, se lleva a cabo con el ácido nítrico diluido, el producto final, es el 2- 4- 6- trinitrofenol, o sea, el explosivo Ácido pícrico:
C6H5 - OH + 3HNO3 C6H2 (NO2)3OH + 3H2O
- Por oxidación forma el Ácido oxálico y productos resinosos. La reacción más importante del fenol, es su condensación con el Formaldehído, contándose con el 60% de la producción del fenol en los EEUU., para la obtención de las llamadas resinas fenólicas:
C6H5 - OH + 3HCHO C6H2 - OH - (CH2OH)3 C6H2 - OH (CH2OH)3 [ C6H2 - OH - (CH2O+)] - 3
- La condensación del fenol y la acetona, den el 4- 4` isopropilidendifenol ó bisefenol A. La condensación del fenol con el anhídrido ftálicoda la fenolftaleina; su reacción con el fenato de sodio y el bióxido de carbono, para formar el ácido salicílico.
- También es de importancia comercial el acoplamiento del fenol con las sales de diazonio, para la obtención de tinturas azo.
- El fenol, sirve como materia prima para obtener la Ecaprolactana, que a su vez es la materia prima para la obtención del Nylon 6, por medio de las siguientes reacciones.
- https://www.ecured.cu/Alcohol
- https://www.ecured.cu/Fenol
Ejercicios:
Alcoholes I
Alcoholes II
Fenoles I
Fenoles II
Webgrafía